Chimie/Biologie: Des couleurs plein les yeux T3 - Des pigments coralliens, mais pour quoi faire ?
|
|

Les pigments des zooxanthelles à dominante brun doré sont à l’origine du brunissement des coraux observé parfois en aquarium (cf des couleurs plein les yeux T1 – Lumière, couleurs et coraux). Les couleurs vives des coraux et d'autres anthozoaires sont dues quant à elles à des pigments d’origine animale (cf des couleurs plein les yeux T2 – Les acteurs de la coloration). Dans cette dernière partie, nous allons examiner plus en détail ces pigments coralliens et leurs rôles potentiels.
Les couleurs des organismes vivants sont généralement données par des pigments de faible poids moléculaire - comme les carotènes - ou par des protéines associées à un groupement non protéique appelé groupement prosthétique "porteur" de la coloration. Les premiers pigments identifiés chez les coraux correspondaient à ces types de molécules bien connues :
* caroténo-protéines (protéines qui tirent leur couleur de leur liaison avec des carotènes) rouges ou vertes (Kawaguti, 1944 ; Takabayashi and Hoegh-Guldberg, 1995).
* dérivés de la biliverdine, proche de la structure du groupement prosthétique de l’hémoglobine (Tixier, 1945, cité par Fox and Wilkie, 1970).
Mais dans ce dernier cas, ces molécules correspondaient à des pigments du squelette des coraux. Jusqu’en 1995, aucune identification de pigments tissulaires des coraux hermatypiques n’avait été réalisée. Or c’est bien à ce type de pigment que nous devons la diversité de couleurs que nous voulons tant conserver dans nos aquariums.
C’est une équipe australienne qui la première a isolé et partiellement purifié le composant responsable des colorations bleu et rose des Pocilliporidae et des Acroporidae (Dove et al., 1995). Les auteurs ont montré qu’il s’agissait d’une protéine composée de deux ou trois sous unités - suivant les cas - de 28kD chacune (le Dalton, abréviation D, est une unité de masse moléculaire correspondant à la masse d’un atome d’hydrogène). La partie de la molécule responsable de la coloration, le chromophore, ne contient pas d’atome métallique contrairement à l’hémoglobine et à la chlorophylle par exemple, et il ne s’agit pas non plus d’une caroténo-protéine. Ils lui ont donné le nom de pocilloporine rappelant ainsi que leurs travaux ont d’abord été réalisés sur des Pocillopora.

Photo : Etienne Dhont
Parallèlement, une autre protéine retenait l’attention de nombreuses équipes scientifiques travaillant dans le domaine des biotechnologies : la Green Fluorescent Protein ou GFP (protéine fluorescente verte). Cette protéine est le premier exemple décrit de chromoprotéine, littéralement protéine colorée, dont la synthèse est autocalalytique.
Elle n’a pas besoin d'enzymes et de cofacteurs pour être synthétisée et activée. Seul la présence d’oxygène est nécessaire. Cela n’a l’air de rien mais ça l'a immédiatement propulsée au rang des outils les plus utiles pour les biotechnologies. Il "suffit" en effet d'inclure le gène de la GFP - son plan de codage - au sein du génome de ce qu'on étudie, et la cellule ou l’organisme se colore en vert (sous illumination UV-A) tout en restant en vie. L'intérêt est considérable pour l'étude des mécanismes du développement, de la cancérisation, pour la toxicologie et bien d'autres domaines encore.
Un marqueur fluorescent vert c'était déjà bien, mais les scientifiques se sont mis à rêver d'avoir à leur disposition toute une palette de couleurs, et la "chasse" à de nouvelles protéines de ce type s'est ouverte. La GFP a été découverte chez Aequorea victoria, une petite méduse bioluminescente, ( cf Morise et al 1974;13:2656–2662 et des couleurs plein les yeux T2). Les recherches se sont donc portées vers d'autres animaux bioluminescents mais sans succès. Ce n'est qu'en 1999 qu'une équipe russe pense à élargir son champ d'investigation en s'intéressant, non plus à des animaux bioluminescents, mais à des espèces qui présentent, dans certaines conditions d'éclairement, une légère fluorescence. Et là, c'est le jackpot (Mats et al., 1999). L'équipe met en évidence six nouvelles protéines apparentées à la GFP (GFP-like en anglais) chez une anémone et chez des coraux "mous" (Zoanthus sp., Discosoma sp.et Clavularia sp.) dont l’une émettant dans le rouge-orangé et l’autre dans le jaune.
Pocilloporines d'un coté, GFP-like de l'autre, deux familles de protéines peuvent prétendre être à l'origine de la coloration des tissus coralliens. Ce n'est qu'en 2001 que l'équipe de SG Dove démontre que la pocilloporine appartient en fait à la famille des GFPs.
L'intérêt que suscite cette famille de protéines au sein de la communauté scientifique dépasse de beaucoup le champ d'investigation des équipes qui travaillent sur la biologie du corail. Les avancées ont donc été relativement rapides et permettent aujourd'hui de mieux comprendre ce que certains continuent d'appeler la pocilloporine. Si la séquence des acides aminés - les briques qui composent les protéines - varie considérablement d'une GFP-like à une autre, la structure tridimensionnelle de ces protéines est remarquablement conservée. Le chromophore implique systématiquement trois acides aminés spécifiques. Dans la GFP d'Aequorea il s'agit d'une sérine (Ser), d'une tyrosine (Tyr) et d'une glycine (Gly) cyclisés et oxydés de manière autocatalytique par la protéine elle même (cf figure 1).
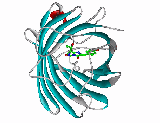
Figure 1 : Structure tridimentionnelle de la GFP. Les acides aminés du chromophore sont colorés en vert.
Pour les autres chromoprotéines, le chromophore comprend toujours l'association Tyr-Gly mais la sérine peut être remplacée suivant les cas par trois autres acides aminés (asparagine, glutamine ou lysine). Ainsi dans le cas de la protéine identifiée par SG Dove c'est la glutamine qui remplace la sérine. De très légères modifications au niveau des ces acides aminés suffisent donc à changer les spectres d'absorption et d'émission de ces protéines (cf figure 2). Dans certains cas, bien qu'il s'agisse toujours de GFP-like, la fluorescence disparaît même complètement et il ne subsiste qu'une simple protéine colorée .
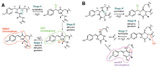
Figure 2 : Cyclisation des acides aminés à l'origine de la coloration de la protéine, aboutissant à une chromoprotéine fluorescente verte ou rouge
Si certains coraux tels que les Tubastrea sp. et Montastrea sp. oranges tirent leurs couleurs de pigments plus classiques comme les carotènes, il est par contre acquis aujourd'hui que cette famille de chromoprotéines apparentées à la GFP est responsable de la coloration d'une grande partie des coraux durs et moux. Cette implication des protéines fluorescentes est longtemps passée inaperçue parce que la fluorescence des coraux ne se révèle que rarement à la lumière du jour. Mais elle est beaucoup plus répandue qu'on ne l'imaginait au départ. Ainsi, parmi 16 familles de coraux étudiées par une équipe australienne sur la Grande Barrière de Corail (Salih et al., 2000), 124 espèces présentaient une fluorescence induite par certaines longueurs d’ondes, une forte proportion d'entres elles vivant dans des zones de faible profondeur. Sachant que certaines protéines, bien qu'appartenant à la famille des GFPs n'expriment plus cette fluorescence, la proportion d'espèces corallienne dont la couleur est donnée par ces chromoprotéines est donc vraisemblablement encore plus importante que cette étude ne le laisse penser.

Photos : David Excoffier, Julien Théodule
D'autre part, ce qui rend également cette famille de protéine si originale, c'est que contrairement aux protéines associées à des chromophore non protéiques, les GFP-like dérivent toutes d'un seul et même gène ancestral (les autre chromoprotéines nécessitent plusieurs étapes, plusieurs enzymes et donc plusieurs gènes pour leur synthèse et leur activation). La diversité de couleurs que nous observons aujourd'hui provient donc de mutations successives dans ce gène ancestral. Les études menées sur ce point montrent d'ailleurs que cette diversité est apparue relativement récemment lors de la différentiation des anthozoaires. La conservation d'un gène sur de grandes périodes de temps indique en général que la protéine codée par ce gène joue un rôle important dans la biologie des espèces concernées. Mais quelles fonctions peuvent expliquer une telle conservation au fil du temps ? Plusieurs hypothèses ont été émises :
Les protéines fluorescentes protégeraient les tissus coralliens des dommages des UV-A
99% des UV (longueur d'onde de 10 à 380 nm) qui atteignent la terre sont des UV-A (315-380 nm). S'ils sont moins énergétiques que les autres UV ils sont par contre plus pénétrants. Contrairement aux UV-B, ils ne sont pas arrêtés par une simple vitre et ils franchissent sans problème les couches cellulaires de l'épiderme pour pénétrer au cœur des cellules du derme qu'ils peuvent endommager irréversiblement (par formation de radicaux libres et ionisation de l'ADN). Il est donc important pour un être vivant de pouvoir s'en protéger efficacement.
Prises isolément, les protéines fluorescentes constituent de moins bons écrans UV que d’autres composants qui absorbent massivement ces longueurs d’onde. C’est notamment le cas de MAAs (mycosporine-like amino acids) - comme la palythine - qui bien qu’incolores ont un pic d’absorption se situant à 320 nm, et qui sont responsables de 95% de l’absorption des radiations à cette longueur d’onde in vitro (Dulap et Chalker, 1986).
Mais la plupart du temps les coraux contiennent plusieurs types de protéines fluorescentes de couleur mais aussi de spectres d’excitation et d’émission différents. La couleur perçue est alors la résultante de ces différentes émissions. Analysées séparément, les spectres d'excitation et d'émission des protéines fluorescentes bleues (PFb) ou vertes (PFv) extraites de certaines variétés d’Acropora nobilis et de Pocillopora damicornis ont les caractéristiques suivantes (Salih et al., 2000) :
* PFb : pic d’excitation à 384 nm, pic d’émission à 480 nm
* PFv : pic d’excitation à 486 nm, pic d’émission 516 nm
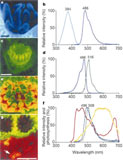
D'après Salih et al., 2000
Reprinted by permission from Dr Hoegh-Guldberg
and from Nature (408:850-853) / Copyright (2000) Macmillan Publishers Ltd : www.nature
.com
La correspondances entre ces pics d‘émission et d’excitation laissent penser que les associations de plusieurs GFPs au sein des tissus coralliens permettraient de moduler l’action de la lumière sur les tissus coralliens.
Si on reprend l’exemple donné ci-dessus, l'association des deux protéines fluorescentes pourrait aboutir à la séquence suivante d'événements :
UV-A (380 nm) =>PFb => 480 nm => PFv: => 516nm
Ce type de processus permettrait donc de transformer une radiation de forte énergie comme les UV-A - de courte longueur d’onde - en des radiations de plus grande longueur d’onde et donc de plus faible énergie et moins nocives pour les tissus coralliens et pour les zooxanthelles.
Les protéines fluorescentess protégeraient les zooxanthelles des trop fortes quantité de lumière dans la plage des longueurs d'onde utiles pour la photosynthèse (PAR, cf des couleurs plein les yeux T1)
Même les longueurs d’ondes utiles pour la photosynthèse deviennent nocives à fortes doses. Des niveaux d'éclairement dépassant les capacités photosynthétiques de l'organisme conduisent à une surproduction de sous-produits de la photosynthèse nocifs pour le chloroplaste. On parle alors de photoinhibition, celle-ci se matérialisant par une diminution de la photosynthèse.
Il a été montré que la cascade des différents pic d’excitation et d’émission des protéines fluorescentes aboutit chez certaines espèces de coraux à la production de longueurs d’onde inactives pour la photosynthèse (entre 550-650 nm) ce qui diminuerait les risques liés aux excés d’éclairement. Ceci est d'ailleurs confirmé par l’étude comparative de trois variétés d’Acropora palifera - fortement, moyennement ou peu fluorescentes - qui a montré que les formes les plus fluorescentes étaient moins sensibles que les autres aux forts niveaux d’éclairement (diminution de la photoinhibition) et que le retour à une activité photosynthétique "normale" était plus rapide chez ces mêmes espèces. Ces constatations ont été étendues par la suite à d’autres coraux comme Acropora nobilis, Pocillopora damicornis et Goniastrea retiformis (Salih et al., 2000).
Les protéines fluorescentes élargiraient le spectre des radiations utiles pour la photosynthèse
Les mêmes mécanismes que ceux décrits précédemment peuvent aboutir, dans le cas de coraux vivant dans des zones de faible éclairement - comme les zones plus profondes du récif - à une meilleure utilisation des radiations disponibles. Certaines associations de protéines fluorescentes peuvent ainsi, transformer les radiations non actives pour la photosynthèse (300-400 nm) en radiation utilisables par les zooxanthelles, soit directement au travers de leur chlorophylles (pics d'absorption vers 420-495 nm et 640- 700 nm) soit au travers des pigments accessoires de la photosynthèse. Le bénéfice pour les coraux serait d’autant plus important qu’avec l’augmentation de la profondeur la proportion de radiations de faibles longueurs d’onde (dont les UV-A) augmentent, les plus grandes longueurs d’onde étant arrêtées en premier. Les protéines fluorescentes seraient donc en mesure d’étendre aux UVs le champ des longueurs d’onde utiles pour la photosynthèse (Dove et al., 2001).
L'action photoprotectrice ou au contraire photoamplificatrice de cette famille de protéines dépendrait donc des caractéristiques des différents spectres d'absorption des protéines fluorescentes et des différentes interactions que ces spectres peuvent avoir entre eux au sein des tissus coralliens.
Cette même dualité entre protection/amplification des effets de la lumière se retrouve dans la localisation des protéines fluorescentes au sein des tissus coralliens
L’examen des tissus coralliens montre que les protéines fluorescentes sont présentes, soit sous forme de microgranules - petits "sacs" de 0.2 à 8 µm -, organisés en couches plus ou moins denses, soit sous forme libre entre les cellules ou même au sein des cellules coralliennes elles-mêmes.
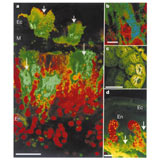
Ec : ectoderme En : endoderme
D'après Salih et al., 2000. Reprinted by permission from Dr Hoegh-Guldberg
and from Nature (408: 850-853) / Copyright (2000) Macmillan Publishers Ltd : www.nature
.com
Chez les espèces soumises à de fortes intensités lumineuses, les chromoprotéines sont situées au dessus des couches tissulaires contenant les zooxanthelles (encart a et c dans la figure ci-dessus). Elles seraient donc en mesure, non seulement de transformer les radiations lumineuses avant qu'elles n'atteignent les zooxanthelles, mais également, en les reflétant, de diminuer la quantité de lumière qui arrive jusqu'aux zooxanthelles.
Ce mécanisme pourrait être contrôlé par le corail lui-même, la contraction du polype entraînant l'agrégation des microgranules en une couche réfléchissante ininterrompue. Enfin, conformément à ce que nous pouvons observer dans nos bacs, les GFPs des coraux fortement éclairés se concentrent plus particulièrement aux extrémités des branches des acroporas et dans les zones de croissance les plus exposées aux fortes intensités lumineuses.
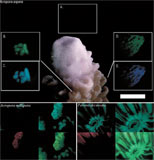
D'après Dove et al., 2001
Reprinted by permission from Dr Hoegh-Guldberg (Coral Reefs. 2001 ; 19 :197-204)
A l'inverse, chez les espèces acclimatées à de faibles niveaux d'éclairement, les protéines fluorescentes se trouvent sous les zooxanthelles, et focaliseraient la lumière vers celles-ci ce qui permettrait à ces animaux d'améliorer encore l'utilisation des moindres radiation lumineuses (encart d, figure Salih et al., 2000 ci dessus). Si cette localisation des GFP-like étaient "régulée" dynamiquement par l'intensité lumineuse, peut-être tiendrions-nous là une explication à ce que nous constatons dans en aquarium. Les très - trop ? - fortes illuminations favoriseraient en quelque sorte la migration ou le maintien des chromoprotéines au-dessus des zooxanthelles et par voie de conséquence, les colorations vertes, rouges ou bleues seraient plus perceptibles. Cette hypothèse personnelle, bien que séduisante, reste à démontrer.
Les chromoprotéines des coraux photosynthétiques jouent donc certainement un rôle fondamental dans l'adaptation de ces animaux à leur environnement lumineux. C’est d’ailleurs peut être l’une des explications à leur conservation sans modification majeure durant des millions d’années et à leur prédominance parmi tant d’espèces coralliennes qui doivent l'essentiel de leur subsistance à la lumière. Une raison de plus pour admirer mais aussi pour tenter de préserver au mieux les animaux que nous hébergeons dans nos bacs.
Références
Kawaguti S. On the physiology of reef corals VI. Study on the pigments. Palao Trop. Biol. Stn. Stud. 1944 ; 2 : 617-673.
Takabayashi M, and Hoegh-Guldberg O. The ecological and physiological differences between two color morphs of the coral Pocillopora damicornis. Mar. Biol. 1995 ; 123 : 705-714.
Fox DL, and DW, Wilkie. Somatic and skeletally fixed carotenoids of the purple hydrocoral, Allopora cahfornica. Camp.Biochem. Physiol. 1970 ; 36: 49-60.
Dove SG, Takabayashi M, Hoegh-Guldberg O. Isolation and partial characterization of Pocilloporid et Acroporid Corals. Bio. Bull. 1995 ; 189 : 288-297
Dove SG, Hoegh-Guldberg O, Ranganathan S. Major colour patterns of reef-building corals are due to family of GFP-like proteins. Coral Reefs. 2001 ; 19 :197-204
Morise H, Shimomura O, Johnson FH, Winant J. Intermolecular energytransfer in bioluminescent system of Aequorea. Biochemistry 1974;13:2656–2662
Matz MV, Fradkov AF, Labas YA, Savitsky AP, Zaraisky AG, Markelov
ML, Lukyanov SA. Fluorescent proteins from nonbioluminescent Anthozoa
species. Nat Biotechnol 1999;17:969–973.
Salih A, Larkum A, Cox G, Kuhl M, Hoegh-Guldberg O. Fluorescent pigments in corals are photoprotective. Nature 2000, 408:850-853
Dulap et Chalker. Identification and quantification of near-uv absorbing compunds (S-320) in a hermatypic scelartinian. Coral Reefs 1986, 5 :155-159
Rechercher les contributions sur ce sujet dans le forum
Poser une question ou partager une expérience sur le forum
Article écrit par Benoit Finet et Florian Lesage, et publié par Récifs.org le 13/04/2005
|
| |
Score Moyen: 4.5
Votes: 8

|
|

