|
|  |
Acide faible, acide fort
a) Acide /base conjuguée
Un acide A est une espèce chimique capable de céder un proton H+, selon la formule AH <=> A- + H+. A- est appelé la " base conjuguée " de l'acide. Réciproquement une base est une espèce chimique capable de capter un proton H+, donc tous les ions chargés négativement sont des bases. L'acide peut se dissocier partiellement ou totalement dans l'eau. Dans le premier cas, cela signifie qu'on trouvera dans l'eau AH, H+, et A- . Dans le deuxième cas, on ne trouvera plus l'acide AH dans la solution, mais seulement sa base conjuguée et H+. Un acide fort est un acide qui se dissocie totalement dans l'eau. Par exemple pour l'acide nitrique : HNO3 -> H+ + NO3-.
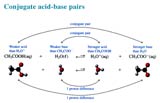 Un acide faible est un acide qui ne se dissocie que partiellement dans l'eau. Par exemple pour l'acide acétique (le vinaigre) : CH3CO2H <=> H+ + CH3CO2-. Cette réaction est un équilibre caractérisé par une constante de dissociation (Ka) qui est propre à chaque acide.
Un acide faible est un acide qui ne se dissocie que partiellement dans l'eau. Par exemple pour l'acide acétique (le vinaigre) : CH3CO2H <=> H+ + CH3CO2-. Cette réaction est un équilibre caractérisé par une constante de dissociation (Ka) qui est propre à chaque acide.
b) Apparition d'espèces en solution selon le pH
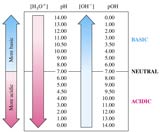
On peut effectuer un classement de ces acides selon leur capacité de dissociation. Le pKa est une grandeur proportionnelle à cette capacité. Plus pKa est petit, plus l'acide est fort (pKa = 0 pour les acide forts tels que les acides nitrique, chlorhydrique ou sulfurique). Plus le pKa est grand, plus l'acide est faible.
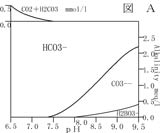 Si on reprend l'exemple : HCO3- <=> H+ + CO32-.
Si on reprend l'exemple : HCO3- <=> H+ + CO32-.
HCO3- est l'acide, et CO32- est la base conjuguée. Le pKA est celui du couple acide/base conjuguée qui pour HCO3- / CO32- vaut 10,3. Pour pH inférieur à 10.3, on trouvera majoritairement en solution l'espèce HCO3-. Si on augmente le pH au-dessus de 10.3, on observera alors que l'espèce CO32- est majoritaire. Selon le pH de la solution, on peut donc faire favoriser la réaction dans un sens ou l'autre.
Remarque sur le CO2 : le dioxyde de carbone est un acide faible (acide carbonique), et même un diacide faible, ce qui signifie qu'il est capable de céder 2 protons :
(1) CO2 + H2O <=> H+ + HCO3-
(2) HCO3- <=> H+ + CO32-
 Nous avons donc ici deux couples acide/base .
Nous avons donc ici deux couples acide/base .
(1) un premier couple CO2 / HCO3- caractérisé par un pKa = 6,35
(2) un second couple HCO3-/ CO32- caractérisé par un pKa=10,3.
Cela signifie que pour une eau dont le pH est inférieur à 6,35 c'est le CO2 qui est majoritaire, pour une eau dont le pH est compris entre 6,35 et 10,3 les HCO3- sont majoritaires, et pour une eau dont le pH est > 10,3 les ions CO32- sont majoritaires. En modifiant le pH, on peut donc faire varier les concentrations des différents ions puisqu'ils sont en équilibre les uns avec les autres.
Chapitre précédent
-
Chapitre suivant
Retour au sommaire
|
|
|
| 
|