 |
|  |
Eau et dioxyde de carbone
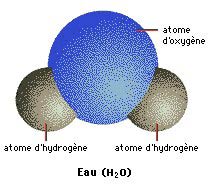 H2O
H2O
L'eau sous forme liquide subit une réaction chimique que l'on nomme autoprotéolyse de l'eau. Elle se traduit par la dissociation d'une molécule d'eau donnant un ion hydrogène H+ (appelé aussi proton) et un ion hydroxyde OH-, selon la formule : H2O <=> H+ + OH- (qui est simplification de 2 H2O <=> H3O+ + OH-, H3O+ ion hydronium étant une forme hydratée du proton). Cette réaction n'est pas totale, ce qui signifie que l'eau ne se dissocie que partiellement ; une molécule d'eau sur 555 millions seulement s'ionise.
Le dioxyde de carbone et l'eau
L'eau pure est un solvant puissant : l'eau pure n'existe donc qu'en théorie. En pratique, le dioxyde de carbone atmosphérique (CO2) s'y dissout, selon la réaction : CO2 + H2O <=> H+ + HCO3-, HCO3- étant l'ion hydrogénocarbonate ou encore bicarbonate. Cet ion se dissocie lui-même pour donner l'ion carbonate (CO32-) selon la réaction HCO3- <=> H+ + CO32-. On obtient donc en solution les espèces chimiques H2O , H+ , OH-, HCO3- et CO32- qui coexistent. Ces réactions sont réversibles et en équilibre. Si on modifie le pH, on entraîne un déplacement des équilibres et une modification des concentrations de chaque espèce.
Chapitre précédent
-
Chapitre suivant
Retour au sommaire
|
|
|
| 
|

