
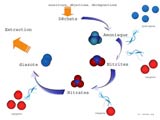
Le cycle de l'azote
Le cycle de l'azote résume l'ensemble des étapes de transformation que subissent les composés azotés au sein du bac. Les êtres vivants sont composés notamment de carbone et d'azote. Par le métabolisme normal des cellules, ou bien lors de la mort de l'individu, des déchets sont produits. Cette matière organique est minéralisée en composés simples par l'activité des bactéries.
a) L'ammonisation
L'ammonisation est la première étape de la dégradation des molécules organiques. Les composés azotés qu'on
trouve dans les urines et fèces, ou bien dans les cadavres, vont être transformés par certaines bactéries sous forme d'ammoniaque. Cette phase se caractérise par la production de deux espèces chimiques : l'ammoniaque NH3 et l'ion ammonium NH4+, liés par la relation chimique NH4+ <=> NH3 + H+.
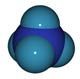 Ces deux composés forment un couple acide/base, NH4+ étant l'acide et NH3 la base conjuguée. Le pKa de ce couple est égal à 9,2, ce qui signifie qu'au-delà d'un pH de 9.2, la forme NH4+ est minoritaire. Pour un pH de 6,5, seulement 0,2% des composés ammoniacaux sont sous forme NH3 alors que pour un pH de 8, 5% des composés ammoniacaux sont sous forme NH3. L'ammoniaque est toxique étant plus toxique que NH4+, on comprend l'intérêt de ne pas trop élever le pH de l'eau de mer lorsque ces composés sont présents (par exemple après un long transport dans un faible volume).
Ces deux composés forment un couple acide/base, NH4+ étant l'acide et NH3 la base conjuguée. Le pKa de ce couple est égal à 9,2, ce qui signifie qu'au-delà d'un pH de 9.2, la forme NH4+ est minoritaire. Pour un pH de 6,5, seulement 0,2% des composés ammoniacaux sont sous forme NH3 alors que pour un pH de 8, 5% des composés ammoniacaux sont sous forme NH3. L'ammoniaque est toxique étant plus toxique que NH4+, on comprend l'intérêt de ne pas trop élever le pH de l'eau de mer lorsque ces composés sont présents (par exemple après un long transport dans un faible volume).
b) La nitrification
La nitrification correspond à la transformation de l'azote ammoniacal en nitrites puis en nitrates. Ces réactions sont effectuées par des bactéries aérobies (nitrosomas, nitrobacter, nitrosomonas, nitrosobacter …) qui utilisent l'azote ammoniacal comme source d'énergie. Ces bactéries sont classiquement situées dans les couches supérieures du sable, des pierres vivantes ou d'autres supports (bioballes, mousses filtrantes pour les bacs de poissons). Les deux opérations de nitrification sont des oxydations c'est-à-dire qu'elles nécessitent l'apport d'oxygène.
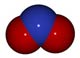 Première étape d'oxydation ammonium/ammoniaque en nitrites (NO2-) :
Première étape d'oxydation ammonium/ammoniaque en nitrites (NO2-) :
2 NH4+ + 3 O2 -> 2 NO2- + 4 H+ +2 H2O
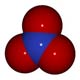 Seconde étape d'oxydation des nitrites en nitrates (NO3-) :
Seconde étape d'oxydation des nitrites en nitrates (NO3-) :
2 NO2- + O2 -> 2 NO3-
En associant ces deux équations, on constate que la nitrification consomme de l'oxygène et acidifie le milieu :
2 NH4+ + 4 O2 -> 2 NO2- + 4 H+ +2 H2O.
c) La dénitrification
Cette étape de dénitrification correspond à la transformation des nitrates en azote gazeux (N2), selon l'équation simplifiée
2 NO3- -> N2 + composés oxydés.
 L'oxygène contenu dans l'ion nitrate est transféré sur d'autres composés, ce qui indique une réduction du composé azoté, et non plus d'une oxydation comme précédemment. Cette réaction est réalisée dans un milieu appauvri en oxygène par des bactéries anaérobiques facultative. En présence d'oxygène (O2), ces bactéries l'utilisent préférentiellement car c'est plus rentable d'un point de vue énergétique. Pour les " forcer " à utiliser l'oxygène contenu dans les nitrates, il faut donc créer un milieu appauvri en O2. On observe classiquement cette transformation au sein des pierres vivantes ou sous une couche de sable épaisse, l'eau dans ces deux endroits ayant été appauvrie en O2 par les bactéries aérobies de surface.
L'oxygène contenu dans l'ion nitrate est transféré sur d'autres composés, ce qui indique une réduction du composé azoté, et non plus d'une oxydation comme précédemment. Cette réaction est réalisée dans un milieu appauvri en oxygène par des bactéries anaérobiques facultative. En présence d'oxygène (O2), ces bactéries l'utilisent préférentiellement car c'est plus rentable d'un point de vue énergétique. Pour les " forcer " à utiliser l'oxygène contenu dans les nitrates, il faut donc créer un milieu appauvri en O2. On observe classiquement cette transformation au sein des pierres vivantes ou sous une couche de sable épaisse, l'eau dans ces deux endroits ayant été appauvrie en O2 par les bactéries aérobies de surface.
En résumé : nitrates (NO3-) -> nitrite (NO2-) -> l'oxyde nitrique (NO) -> l'oxyde nitreux (N2O) -> diazote (gazeux) (N2).
On notera que ces bactéries ont besoin de carburant ET de comburant ; l'absence de composés carbonés peut empêcher le bon déroulement de la dénitrification car les bactéries n'ont alors pas assez de ces composés à leur disposition pour réduire correctement les nitrates. Ce syndrome apparaît dans les bacs surécumés. A l'issue de la dénitrification, on obtient donc la transformation des nitrates en azote gazeux, qui est exporté du bac par simple équilibration des pressions entre le bac et l'atmosphère. Il n'y a donc pas d'accumulation dans le bac.
Chapitre précédent
-
Chapitre suivant
Retour au sommaire
|
|